Роль бактериальных токсинов в патологии
Яна Булавко, СПбГПМУ
Бактериальные токсины – это важнейшие факторы патогенности, вырабатываемые микроорганизмами и реализующие основные механизмы инфекционного процесса. По способу выделения в окружающую среду различают экзотоксины и эндотоксины. Экзотоксины – это белки, которые секретируются бактерией в окружающую среду, обладают ферментативной активностью и высокой иммуногенностью. Они действуют дистантно на клетки и ткани. В зависимости от клетки-мишени выделяют: нейротоксины (тетаноспазмин, ботулинический токсин), гемолизины (гангренозный токсин, стафилококковый токсин), энтеротоксины (холероген, токсин кишечной палочки), дерматонейротоксины (дифтерийный токсин, коклюшный токсин), лейкоцидины (стафилококковый токсин, стрептококковый токсин). Очень многообразны и механизмы действия экзотоксинов. Цитотоксины — токсины, блокирующие синтез белка на клеточном уровне (дерматонекротоксины стафилококка, палочки сибирской язвы, синегнойной палочки, возбудителя коклюша); сюда же относят антиэлонгаторы — препятствующие элонгации полипептидной цепи или транслокации рибосом, и тем самым блокирующие синтез белка через инактивацию рибозил-трансферазы (дифтерийный токсин [Вяльба Е. В. и др.,1998], токсин синегнойной палочки); мембранотоксины – токсины, частично разрушающие клеточную мембрану с последующим выходом содержимого клетки в окружающую среду (гемолизины, лейкоцидины стафилококков, стрептококков); функциональные блокаторы — блокируют передачу нервных импульсов в синапсах, в клетках спинного и головного мозга (тетаноспазмин, ботулинический токсин); эксфолиатины (некоторые штаммы золотистого стафилококка) и эритрогенины (пиогенный стрептококк группы А), которые влияют на процесс взаимодействия клеток между собой и с межклеточными веществами. Также выделяются токсины, повреждающие пути метаболизма, контролируемые вторичными мессенджерами, например через угнетение белков, регулирующих активность аденилат-циклазы (сибириязвенный токсин), гликозил-трансферазы (токсин C. difficile) или через стимуляцию гуанилат-циклазы (токсин кишечной палочки, йерсинеозный токсин) [Афонькин С.Ю. и др., 2000]. В особую группу следует отнести суперантигены: они связывают MHC класса II на поверхности антиген-презентирующих клеток (макрофагов, дендритных клеток) с рецептором T-хелперов, что вызывает активную пролиферацию большой пропорции Т-лимфоцитов, независимо от их антигенной специфичности, и сопровождается массивным высвобождением лимфоцитарных (интерлейкин [ИЛ]-2, фактор некроза опухолей [ФНО], гамма-интерферон) и моноцитарных (ИЛ-1, ИЛ-6, ФНО) цитокинов. Клинически такая реакция проявляется в виде гипотензии, высокой температуры тела и диффузной эритематозной сыпи, которые характерны для синдрома токсического шока [Clare K. et al, 1999]. К таким суперантигенам относятся стафилококковые энтеротоксины, токсины микоплазм и кампилобактеров. Инвазивность бактерий, распространение по организму и устойчивость к иммунитету хозяина зачастую определяется наличием экзоферментов: плазмокоагулазы, фибринолизина, гиалуронидазы, лецитовителлазы, ДНК-азы, нейраминидазы, уреазы. Кроме того, расщепляя специфические структуры до мономеров с помощью экзоферментов, бактерии получают необходимые питательные вещества. Эндотоксины представляют собой липополисахариды (ЛПС), которые
синтезируются в организме бактерии, связаны с клеточной стенкой и высвобождаются только после гибели бактерии. Они являются провоспалительными агентами: повышают проницаемость капилляров, вызывают лихорадку за счет выброса пирогенов из гранулоцитов и моноцитов и оказывают разрушающее действие на клетки и ткани. Эндотоксины имеют слабое иммуногенное действие, но при попадании большого количества токсина в кровь вызывают эндотоксиновый шок, который может привести к смерти. Существует мнение, что ЛПС являются критически важными факторами для поддержания барьерной функции бактериальной стенки, заключающейся в препятствии проникновению липофильных веществ (антибиотиков и детергентов) в клетку. Способность бактериальной клеткой синтезировать токсин связана с наличием генов, кодирующих этот токсин, в геноме клетки. Наблюдается некоторое генетическое родство (гомология) токсинов с ферментами, интерферонами, гормонами эукариотических клеток [Ю.В. Вертиев, 1996]. Возможно, что в процессе эволюции токсины возникли вследствие захвата бактерией части генетического материала у эукариот. Современная бактериальная клетка может приобретать способность к синтезу токсинов в любой момент благодаря плазмидам и бактериофагам. Плазмиды – участки ДНК, отщепившиеся в процессе филогенеза от нуклеоида и кодирующие определенный признак. В результате конъюгации происходит обмен плазмидами между бактериями. Затем начинается реализация генетического материала в другом «хозяине». Так клетка приобретает новые свойства. Процесс обмена генетическим материалом с помощью лизогенного бактериофага получило название «трансдукция». Известно, что для размножения лизогенные фаги встраивают свой геном в генетический материал хозяина. При расщеплении ДНК для формирования новых фагов часть генов пораженной клетки может быть захвачена и перенесена в другую клетку, придавая ей новые свойства [Супотницкий М.В., 2000]. Примером такого переноса является бета-фаг, который переносит ген tox, кодирующий дифтерийный токсин. Как уже было упомянуто, токсины играют основополагающую роль в патогенезе заболевания. Клинические проявления зависят от клеток-мишений, на которые направлено действие токсинов, например кишечные инфекции (энтеротоксины кишечной палочки, йерсиний, возбудителя дизентерии, возбудителя тифа и другие), столбняк (тетаноспазмин), газовая гангрена (гангренозный токсин), ботулизм (ботулотоксин), абсцессы (токсин золотистого стафилококка), пневмония (токсин пневмонийного стрептококка), сибирская язва (сибиреязвенный токсин), коклюш (коклюшный токсин), псевдомембранозный колит (токсин C. difficile), холера (холерный токсин) [Fasano A. et al, 1991], и многие другие. Как же организм защищается от токсинов? Вариант неспецифической защиты - детоксикация путем связывания с белками в процессе ферментативных реакций в печени. ABC-транспортеры (АВС-транспортные белки функционируют за счет энергии АТФ, перенося самые разные соединения. Отсюда и название - АТР- binding cassette (ABC) transportes) связываются с токсином и переносят его через цитоплазматическую мембрану внутрь клетки, где происходит дальнейшая ферментация. Еще один неспецифический механизм защиты от токсинов – агрессивные среды организма (кислая среда желудка). Экзотоксины – это белки, которые под воздействием агрессивной среды денатурируют и теряют свои патогенные свойства. При специфическом иммунном ответе на защиту организма от токсинов встают специфические нейтрализующие АТ (антитоксины). Так формируется естественный активный антитоксический иммунитет. Иммуноглобулины различных классов
агглютинируют или преципитируют бактерии и их токсины. Установлено, что нейтрализованные комплексы антитоксин-токсин в дальнейшем выводятся из организма с потом, мокротой, мочой, фекалиями. Широкое применение в медицине имеют антитоксические сыворотки против токсинов, выделяемых патогенными микроорганизмами (палочками дифтерии, столбняка, газовой гангрены и ботулизма), используемые для профилактики и лечения этих болезней – формирования искусственного пассивного антитоксического иммунитета. Наибольшее значение имеют антитоксины, которые вырабатываются против экзотоксинов возбудителей высокотоксигенных инфекций: дифтерии, столбняка, газовой гангрены, ботулизма, скарлатинозного стрептококка, стафилококка. Исходя из материалов недавних исследований установлено [Alistair B. et al, 2011], что бактерии, населяющие макроорганизм, способны использовать свой токсин, чтобы защищаться от своих конкурентов: например, энтеротоксин кишечной палочки предотвращает действие холерного экзотоксина и шига-токсина. Схожий механизм адаптации найден и у синегнойной палочки. Псевдомонады с помощью устройства по типу «молекулярного шприца» впрыскивают в организм конкурента токсины, которые повреждают клеточную стенку и проводят к лизису конкурирующей бактерии. В то же время, у синегнойной палочки существуют собственные механизмы защиты от повреждения, вследствие воздействия токсинов других бактерий, так называемые иммунные белки. В настоящее время данные факты используются для разработки антибактериальной терапии. Бактериальные токсины являются актуальной проблемой нашего времени, ведь именно от них зависит патогенез заболевания и его последующее лечение. С каждым днем открываются все новые и новые токсины. Одним из таких примеров является токсин холерного вибриона [Baudry B. et al, 1992]. ZOT (Zonula occludens toxin, или токсин-блокатор десмосом) представляет собой энтеротоксин. Его действие основано на увеличении проницаемости кишечника. Взаимодействуя с рецепторами клеток человека, он активирует внутриклеточный сигналинг, приводящий к разборке межклеточных десмосом. Так, еще больше увеличивается выход воды в просвет кишечника, что усугубляет дегидратацию при холере. Недавно был обнаружен еще один токсин, вырабатываемый возбудителем холеры – ACE (Accessory Cholera Enterotoxin, или дополнительный холерный энтеротоксин). Предварительные исследования с использованием токсина на животных показали, что AСЕ увеличивает трансцеллюлярный АТФ-зависимый ионный транспорт, который вносит свой вклад в развитие диареи и нарушение электролитного баланса при холере [M Trucksis et al, 1993]. Нередко бактерии прибегают к самоубийству, чтобы сородичи успешнее заразили организм. Например, S. typhi-murium вырабатывает токсин TTSS-1, вызывающий воспаление кишечника. Он уничтожает кишечную микрофлору, расчищая место для бактерии, одновременно убивая многих ее представителей. В центре просвета кишечника только 15% S. typhi-murium выделяют этот фактор, у стенки – практически все. Чем больше бактерий населяет кишку, тем больше погибает «пристенных». Это помогает оставшимся победить микрофлору кишечника [Ackermann M. et al, 2008]. Саморазрушающая кооперация зависит от генов, контролирующих суицидальное поведение, которые не всегда экспрессируются, то есть эффект гена не всегда выражен. В результате, только часть бактерий вырабатывают фактор TTSS-1. Исследователи считают, что феномен саморазрушающей кооперации появляется,
если достаточно велико «общественное благо», во имя которого она совершается, в данном случае - воспаление кишечника. В случае S. typhi-murium выгода в минимизации количества необходимых для заражения бактерий, их требуется не более ста. Другой представитель микромира, который имеет альтруистические наклонности – S. pneumoniae. Бактерия, наряду с токсином (Z-токсин), синтезирует антитоксин, который дезактивирует патогенный фактор [Mutschler H. et al, 2011]. При неблагоприятных условиях, стрессе, антитоксин разрушается, и токсин поражает бактериальную клетку, с последующей ее гибелью. Действие токсина сходно с действием пенициллина: разрушение клеточной стенки на последнем этапе деления. Но у данного механизма есть и другая цель: повысить колонизацию своего штамма. Бактерии с помощью Z-токсина совершают самоубийство, выделяя во внутреннюю среду макроорганизма эндотоксины. Организм хозяина обращает свои иммунные силы на подавление выделившегося эндотоксина, в то время как остальные штаммы стрептококка активно размножаются и заселяют организм. Эти открытия согласуются с теорией эволюции альтруизма и кооперации. Особи с выраженным эффектом генов альтруизма имеют тенденцию к исчезновению. Но если он проявляется не всегда, альтруистично гибнущие экземпляры повышают шанс выжить своим сородичам [Ackermann M. et al, 2008]. Многие бактериальные клетки несут в своем геноме информацию о CDT (cytolethal distending toxin, цитотоксичный расширяющий токсин), который воздействует на различные клетки ЖКТ, чтобы остановить течение клеточного цикла, нанеся повреждения ДНК [Haghjoo E. et al, 2004]. CDT состоит из трех белков: CDTA, CdtB и CDTC. CdtB является ферментативно активной субъединицей, которая обладает ДНКаза-подобной активностью. Функция CDTA и CDTC заключается в обеспечении доставки патогенного белка CdtB в клетки-мишени. CDT впервые был описан в культуре Campylobacter и некоторых штаммов энтеропатогенной E.coli . Примечательно, что эукариотические клетки, пораженные энтеротоксином, медленно разбухают, в течение 2-5 дней. Это, в конечном итоге, приводит к их гибели. Данный токсин был идентифицирован и во многих других бактериях, в том числе в других штаммах E. Coli, S. dysenteriae, S. enterica серовар Typhi, H. ducreyi, и др. Особого внимания заслуживает S. thyphi. Эта бактерия вызывает брюшной тиф, приводящий к более 200 000 смертей ежегодно. В отличие от других сероваров сальмонелл, которые, как правило, ограничиваются развитием гастроэнтерита, S. typhi вызывает системное, опасное для жизни заболевание. В 2013 году был открыт тифоидный токсин А2В5, который и определяет патогенез заболевания [J.Song et al, 2013] . В отличие от типичных AB-токсинов, тифоидный токсин состоит из двух субъединиц А, PltA и CdtB. Они представляют собой ферментативно активные гомологи субъединиц А коклюша и CDT, описанного ранее. PltA имеет АДФ-рибозил трансферазную активность. Происходит присоединение АДФ-рибозы к субъединицам G-белков, что приводит к их конформационной перестройке, и как следствие - активации аденилатциклазы (фермент, катализирующий реакцию превращения АТФ в 3',5'-цАМФ) [Spano S., 2008]. Этот процесс приводит к чрезмерному образованию цАМФ и никак не контролируется клеткой-xозяином. В свою очередь цАМФ вызывает переход больших количеств ионов натрия и воды из клеток в просвет кишечника. Нарушение водно-солевого баланса приводит к диарее. CdtB имеет ДНК-азную активность: наносит повреждения ДНК и вызывает нарушение клеточного цикла и гибель клеток. Субъединица B, PltB, является гомологом одного из компонентов B-субъединицы токсина коклюша и отвечает за доставку токсина в
клетку, посредством рецептор-зависимого эндоцитоза. S. typhi производит тифоидный токсин только в клетках млекопитающих, и токсин затем поступает во внеклеточную среду с помощью уникального механизма транспортировки. У человека, пораженного S. thyphi, наблюдается высокая температура в качестве сильного иммунного ответа на наличие возбудителя в организме. Однако введение мышам тифоидного токсина без возбудителя не вызывает повышение температуры. Этот факт свидетельствует о том, что лихорадка, очевидно, является результатом действия эндотоксина. Заключение. Исходя из представленного материала можно сделать выводы: 1) Бактерии обладают многообразным арсеналом токсинов. Роль этих токсинов важна для симптоматики конкретных заболеваний;
2) В то время как эндотоксин вызывает главным образом пирогенную реакцию, экзотоксины оказывают уникальное воздействие на различные клеточные структуры и процессы;
3) Токсины представляют из себя не только важные мишени терапевтических препаратов будущего, но и интересные потенциальные агенты для селективной доставки противораковых веществ и апоптотических сигналов к тем или иным клеткам.
Таблица 1. Основные механизмы действия токсинов
|
Механизм действия |
Возбудитель |
Название токсина |
Примечание |
||
|
Нейротоксины (блокаторы синаптической передачи) |
C.botulinum |
Ботуллотоксин |
Угнетение ацетилхолиновых синапсов |
||
|
C. tetanus |
Тетаноспазмин |
Угнетение ГАМК синапсов |
|||
|
Блокаторы синтеза белка |
C.diptheriae |
Дифтерийный токсин |
АДФ-рибозилирование фактора элонгации |
||
|
S. dysenteriae, E. Coli |
Shiga-токсин (веротоксин) |
Инактивация рибосомальной РНК |
|||
|
S. thyphi |
Тифоидный токсин A2B5 |
Повреждение ДНК |
|||
|
E. Coli, S. dysenteriae H.hepaticus S.Typhi |
CDT (cytolethal distending toxin) |
Повреждение ДНК, набухание клетки с последующим разрывом |
|||
|
Мембранотоксины |
C. perfringens |
О-перфринго- лизин |
Гидролиз фосфолипидов мембраны |
||
|
S. pyogenes |
О-стрептолизин |
Гидролиз профибринолизина, растворение тромбов |
|||
|
E. coli |
Гемолизин |
Гидролиз плазматической мембраны |
|||
|
V. cholerae |
ZOT |
Разрушение десмосом между энтероцитами |
|||
|
S. pneumoniae |
Пневмолизин |
Гидролиз фосфолипидов мембраны |
|||
|
Изменение активности вторичных посредников |
E.coli |
LT |
Ингибирование G-белков под действием АДФ-рибозил- трансферазы |
||
|
S. thyphi |
Тифоидный токсин A2B5 |
||||
|
B. anthracis |
Отечный фактор |
Накопление цАМФ вследствие активации аденилатциклазы |
|||
|
B. pertussis |
Дермонекро- тический токсин |
Активация ГТФ-связывающего белка Rho, что ведет к нарушению цитоскелета |
|||
|
C. difficile |
Токсин А |
Активация ГТФ-связывающего белка Rho, что ведет к нарушению цитоскеклета, увеличению цГМФ |
|||
|
V. cholerae |
ACE |
Увеличение АТФ-зависимого ионного транспорта |
|||
|
АВ5 (холероген) |
Накопление цАМФ |
||||
|
вследствие активации аденилатциклазы |
|||
|
Суперантигены |
S.pyogenes |
Пирогенные экзотоксины |
Образование комплексов Рецептора Т-клеток и МНС II с последующей поликлональной активацией |
|
S.aureus |
Токсин токсического шока, |
||
|
SEA, SEB, и др. |
|||
Основные механизмы действия некоторых видов токсинов
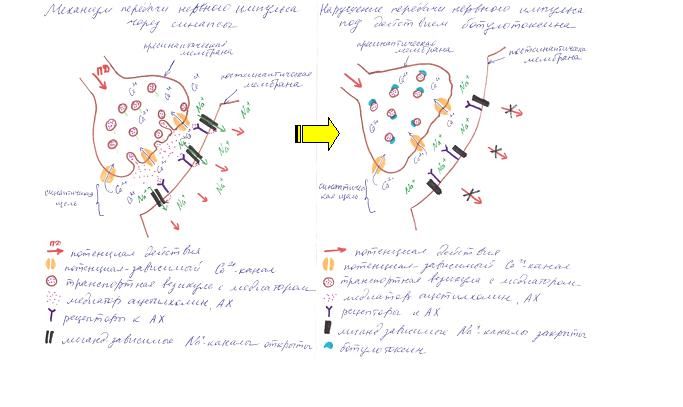
Рисунок 1. Нейротоксины
Клеточными мишенями ботулинического токсина и тетаноспазмина является группа белков, необходимых для стыковки и соединения синаптических пузырьков с пресинаптическими плазматическими мембранами с последующим высвобождением нейромедиаторов [Halpern JL et al, 1995]. Ботулинический токсин блокирует транспортные белки SNAP-25 и синаптобревин. Это приводит к нарушению высвобождения ацетилхолина, препятствуя таким образом передаче нервного импульса на постсинаптическую мембрану и последующего его распространения. [Arnon
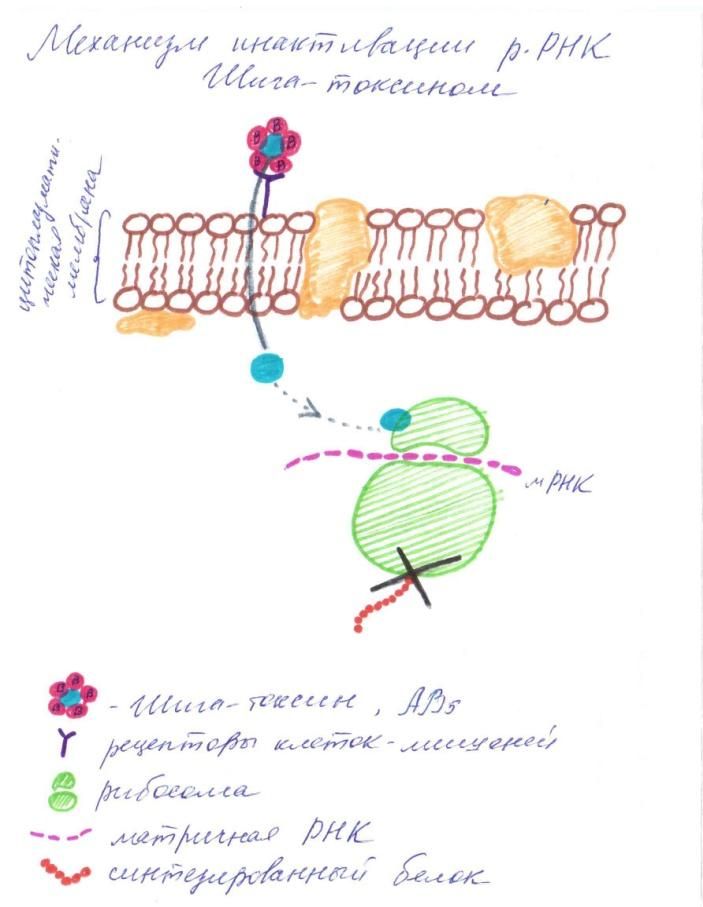
Рисунок 2. Блокаторы синтеза белка Шига-токсин является типичным АВ-токсином. Пентамер из В-субъединиц связывается со специфическими рецепторами клеток-мишеней, осуществляя доставку ферментативно активной А-субъединицы в клетку. Субъединица А действует как N-гликозидаза, отщепляя единичный адениновый остаток от малой субъединицы рРНК, что приводит в конечном итоге к подавлению синтез белка в пораженной клетке [Clare K. et al, 1999].
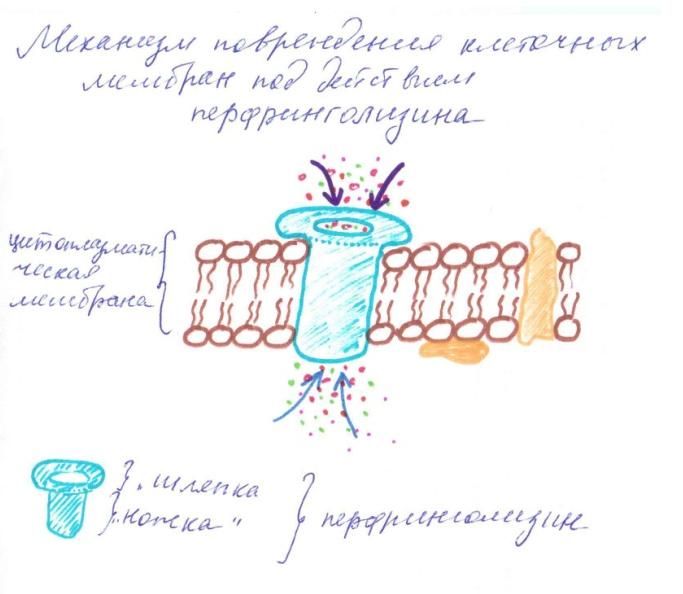
Рисунок 3. Мембранотоксины Альфа-токсин (перфринголизин) - это мощный цитотоксин, обладающий свойствами фосфолипазы С. Он расщепляет фосфолипиды (лецитин) клеточных мембран, лизируя клетки. После связывания с мембраной клетки-мишени "ножка" aльфа-токсина внедряется в пораженную клетку и нарушает вход и выход ионов [Clare K. et al, 1999]. При газовой гангрене альфа-токсин служит не только главным эффектором внутритканевой инвазии, но и причиной внутрисосудистого гемолиза - символа смертельной клостридиальной токсинемии.
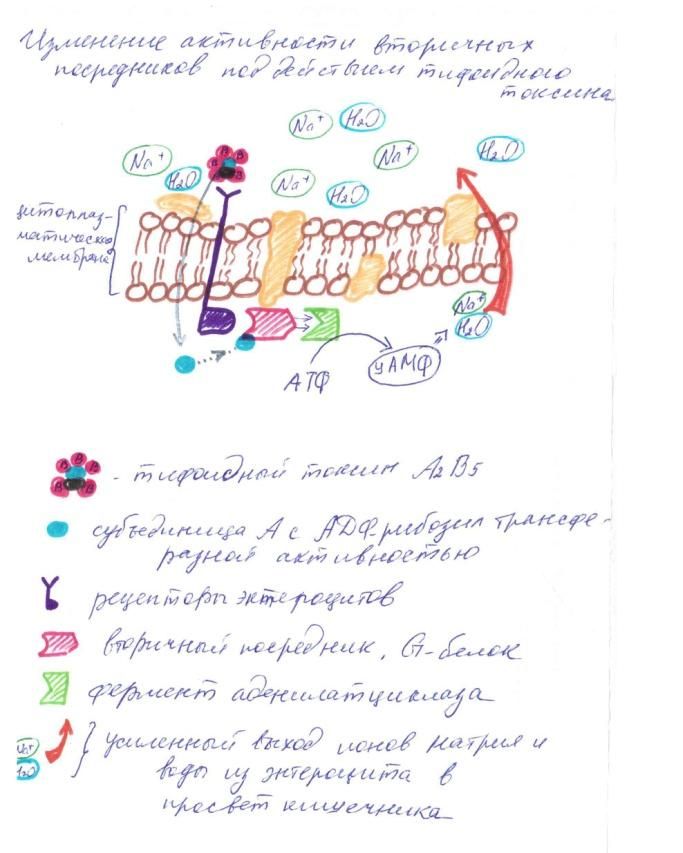
Рисунок 4. Изменение активности вторичных посредников C помощью В-субъединиц тифоидный токсин (А2В5) связывается с рецепторами энтероцитов и проникает в клетку. Одна из субъединиц A тифоидного токсина обладает АДФ-рибозил трансферазной активностью. Происходит присоединение АДФ-рибозы к субъединицам G-белков, что приводит к их конформационной перестройке, и как следствие, активации аденилатциклазы (фермента, катализирующего реакцию превращения АТФ в 3',5'-цАМФ). Этот процесс приводит к чрезмерному образованию цАМФ и никак не контролируется клеткой-xозяином. В свою очередь цАМФ вызывает переход больших количеств ионов натрия и воды из клеток в просвет кишечника. Следствие этого – изнуряющие поносы и потеря воды организмом [Афонькин С.Ю. и др., 2000].
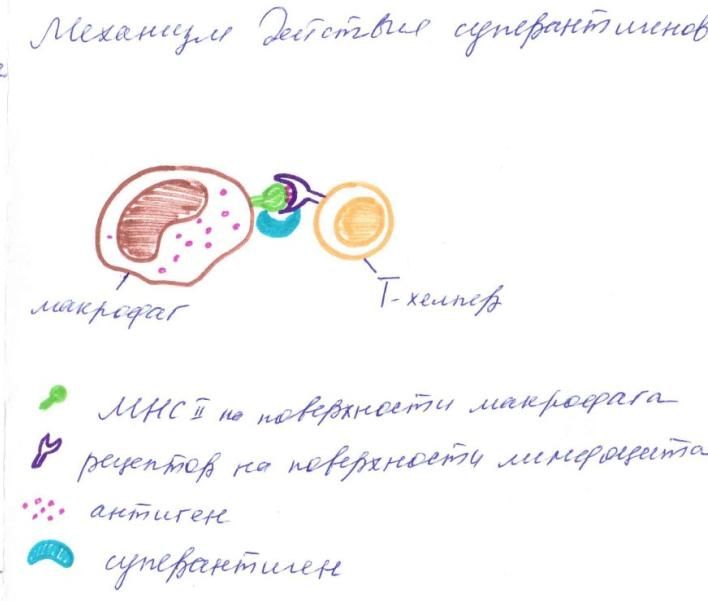
Рисунок 5. Суперантигены Энтеротоксины стафилококков способствуют прочному связыванию MHC класса II на антигенпрезентирующх клетках (макрофагах, дендритных клетках) с антигенными рецепторами на T-хелперах. Это вызывает активацию лимфоцитов, что сопровождается массивным выбросом цитокинов, лихорадкой и диареей
Список литературы:
- 1. Афонькин С.Ю., Пинаев Г.П. Цитоскелет сигнализирует. Биология: прил. к газ. "Первое сент.", 2000, №. 21: 6.
- 2. Вяльба Е. В., Ющук Н. Д. Лечащий врач. Дифтерия, 1998 №. 3: 4-8. http://www.lvrach.ru/1998/03/4526719
- 3. Супотницкий М.В. Микроорганизмы, токсины и эпидемии. Вузовская книга, 2000, 374.
- 4. Ackermann M., Stecher B., Freed N.E., Songhet P., Hardt. W.D., Doebeli M. Self-destructive cooperation mediated by phenotypic noise. Nature, 2008 №. 454: 987-990 http://ras.imbp.ru/index.php?id=94
- 5. Alistair B. Russel I., Rachel D. Hood, Nhat Khai Bui, Michele LeRoux, Waldemar Vollmer, Joseph D. Mougous. Type VI secretion delivers bacteriolytic effectors to target cells. Nature, 2011 №.475: 343–347. http://www.nature.com/nature/journal/v475/n7356/full/nature10244.html
- 6. Arnon S.S. Human tetanus and human botulism. In: Rood JI, McClane BA, Songer JG, Titball RW, editors. The clostridia: molecular biology and pathogenesis, San Diego: Academic Press,1997: 95-115.
- 7. Baudry B., Fasano A., Ketley J., Kaper J.B. Cloning of a gene (zot) encoding a new toxin produced by Vibrio cholera [Abstract]. Infect Immun, 1992 №.60(2): 428–434.
- 8. Clare K. Schmitt, Karen C. Meysick, and Alison D. O'Brien. Bacterial Toxins: Friends or Foes? Emerging Infectious Diseases journal, 1999, №.2(1): 4-15.
- http://www.antibiotic.ru/cmac/2000_2_1/004.htm
- 9. Fasano A., Baudry B., Pumplin D.W., Wasserman S.S., Tall B.D., Ketley J.M., Kaper J.B. Vibrio cholerae produces a second enterotoxin, which affects intestinal tight junctions [Abstract]. Proc Natl Acad Sci. USA, 1991, №.88(12): 5242–5246.
- 10. Haghjoo E., Galan J.E. Salmonella typhi encodes a functional cytolethal distending toxin that is delivered into host cells by a bacterial-internalization pathway. Proc. Natl. Acad. Sci. USA, 2004 №.101(13): 4614-4619.
- 11. Halpern J.L., Neale E.A. Neurospecific binding, internalization and retrograde axonal transport. Curr Top Microbiol Immunol 1995, №.195: 221-41.
- 12. Mutschler H., Gebhardt M., Shoeman R.L., Meinhart A. A novel mechanism of programmed cell death in bacteria by toxin-antitoxin systems corrupts peptidoglycan synthesis. PLoS Biol, 2011 №.9(3): 1-12.
- 13. Song J., Gao X., Galán J. E.. Conferring Virulence: Structure and Function of the chimeric A2B5 Typhoid Toxin. Nature, 2013; №.499(7458): 350–354. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4144355/
- 14. Spano S. Delivery of a Salmonella Typhi exotoxin from a host intracellular compartment, 2008. Cell Host Microbe. №.3(1): 30-38.
- 15. Trucksis M., Galen J. E., Michalski J., Fasano A., and Kaper J. B. Accessory cholera enterotoxin (Ace), the third toxin of a Vibrio cholerae virulence cassette.[Abstract]. Proc Natl Acad Sci USA, 1993; №.90(11): 5267–5271. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC46697